×
Kasutatavad lühendid
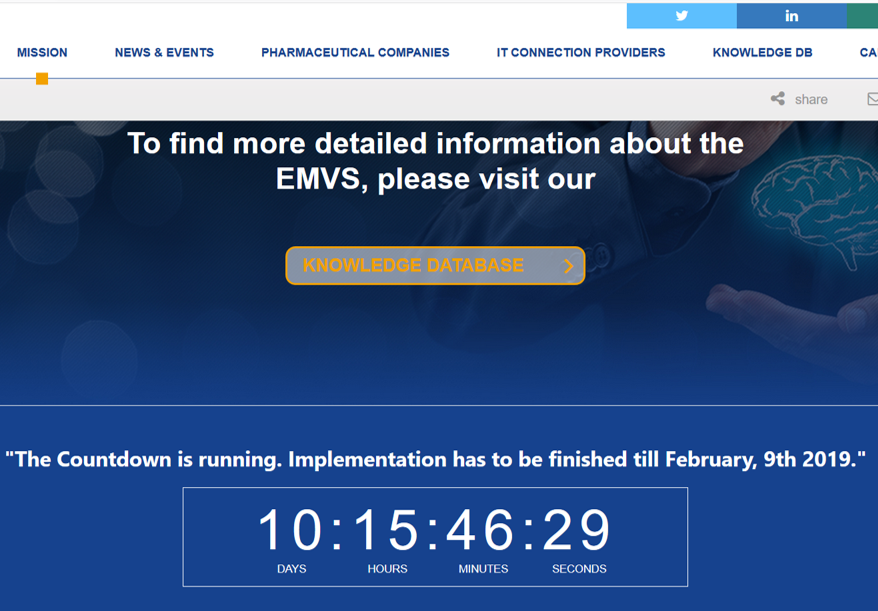
FMD – Falcified medicines directive –
Euroopa Parlamendi ja nõukogu direktiiv 2011/62/EL, 8. juuni 2011,
millega muudetakse direktiivi 2001/83/EÜ (inimtervishoius kasutatavaid
ravimeid käsitlevate ühenduse
eeskirjade kohta) seoses vajadusega vältida
võltsitud ravimite sattumist seaduslikku tarneahelasse
EMVS – European Medicines
Verification System – Euroopa ravimite ehtsuse kontrolli süsteem
(koosneb kesksest osast, millega on liidestatud erinevate riikide
andmekogud)
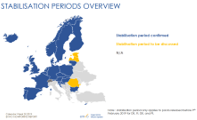
NMVS – National Medicines Verification System – konkreetse riigi ravimite ehtsuse kontrolli süsteem (liidestunud EMVS’ga)
Arvato – REKS arenduspartner (Blueprint lahenduse arendaja)
BP – Blue Print – süsteemi tehniline lahendus
EtMVS – Estonian Medicines Verification System – Eesti ravimite ehtsuse kontrolli süsteem
REKS – Estonian Medicines Verification Organisation - Ravimite Ehtsuse Kontrolli SA
RTL – Association of Pharmaceutical Manufacturers of Estonia – Eesti Ravimtootjate Liit
Efpia – European Federation of Phamaceutical Industries and Associations
MfA – Medicines for Europe
GIRP - Groupement International de la Repartition Pharmaceutique
EAEPC - European Association of Euro-Pharmaceutical Companies
PGEU - Pharmaceutical Group of the European Union
HOPE - European Hospital and Healthcare Federation